|
Niveles de glucosa y lactato en plasma sanguíneo de caninos durante la primera hora de cirugía
ARTÍCULO DE INVESTIGACIÓN
José Henry Osorio1, 2, Yoccner Edilson Quenán2, Leonardo Giraldo-Jiménez1
1 Laboratorio de Investigación en Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas. 2 Laboratorio de Investigación en Metabolismo. Grupo de Investigación en Ciencias Biomédicas. Universidad de Manizales.
This email address is being protected from spambots. You need JavaScript enabled to view it.
(Recibido: 18 de julio de 2015 Aprobado: 16 de Septiembre de 2015 Actualizado: 7 de Diciembre de 2015)
DOI: 10.17151/vetzo.2015.9.2.7
RESUMEN: La cirugía en animales genera un estrés quirúrgico-metabólico, producto de la anestesia y demás procesos durante el acto quirúrgico que obliga al organismo a acondicionar su metabolismo basal. El objetivo es comparar los niveles de glucosa y lactato en plasma sanguíneo de los caninos sometidos a cirugía bajo anestesia general, analizando su correlación durante la primera hora de cirugía. Se obtuvieron muestras de plasma sanguíneo en ayunas de 19 caninos adultos de raza criollos entre machos y hembras, los cuales ingresaron a diferentes procedimientos quirúrgicos bajo anestesia general. Los resultados fueron analizados a través del programa estadístico IBM SPSS Statistics 23. Los niveles de glicemia (mg/dl) en los pacientes antes de iniciar la cirugía, de acuerdo con las medias presentan valores de 99,47±14,51 y sometidos a cirugía bajo efectos de anestesia general, en función del tiempo tienen los siguientes valores: 91,68±18,97, 104,21±38,09, 115,31±34,42 y 117,15±30,62. Se observa diferencia estadísticamente significativa (P<0.005). Los niveles de lactato (mmol/L) en los pacientes antes de iniciar la cirugía, de acuerdo con las medias, presentan valores de 2,47±1,2 y los sometidos a cirugía bajo efectos de anestesia general, en función del tiempo tienen los siguientes valores: 2,23±0,98, 2,4±1,32, 2,02±1,002 y 1,7±1,5. Se observa que no hay diferencia estadísticamente significativa (P>0,005). En todos los pacientes se detectó estrés metabólico con la subsecuente elevación de los niveles de glucosa en la primera hora del procedimiento quirúrgico, en tanto que los niveles de lactato no tuvieron variaciones significativas.
Palabras clave: estrés quirúrgico, metabolismo, pequeños animales, predictores metabólicos
Lactate and glucose levels in blood plasma of dogs during the first hour of surgery
ABSTRACT: Animal surgery generates a surgical-metabolic stress product of anesthesia and other processes during surgery that forces the body to condition its basal metabolism. The goal is to compare the levels of glucose and lactate in blood plasma of dogs undergoing surgery under general anesthesia, analyzing their correlation during the first hour of surgery. Blood plasma samples were obtained from 19 Creole breed fasting, adult dogs between males and females, which entered different surgical procedures under general anesthesia. The results were analyzed through the IBM SPSS Statistics 23 program. The levels of glucose (mg/dl) in patients before surgery, according to the mean present values of 99.47± 14.51, and subjected to surgery under general anesthesia effects, depending on time have the following values: 91.68±18.97, 104.21±38.09, 115.31±34.42 and 117.15±30.62. Statistically significant difference (P<0.005) was observed. Lactate levels (mmol/L) in patients before surgery, according to average, have values of 2.47±1.2 and those undergoing surgery under general anesthesia effects depending on time have the following values: 2.23±0.98, 2.4±1.32, 2.02±1.002 and 1.7±1.5. It is observed that there is no statistically significant difference (P>0.005). In all patients metabolic stress was detected with subsequent elevation of glucose levels in the first hour of the surgical procedure, while lactate levels did not have significant variations.
Key words: surgical stress, metabolism, small animals, metabolic predictors
Introducción
La cirugía animal implica que el animal se encuentre bajo anestesia quirúrgica, ambas influyen directamente sobre el estado bioquímico y fisiológico del animal. La anestesia quirúrgica tiene como finalidad asegurar un estado de inconsciencia, relajación muscular, analgesia, pérdida progresiva de reflejos hasta la supresión de los mismos y equilibrio de los signos vitales (Flecknell et al., 2015). La anestesia general es un estado de intoxicación controlada reversible que implica cuatro factores: hipnosis o pérdida de la conciencia, ausencia de dolor (analgesia), control del sistema vegetativo y relajación muscular; estos conllevan al paciente a un estado de estrés y por ende desencadena una serie de vías metabólicas, que fueron descritas anteriormente (Kutza et al., 1997; Regueiro-Purriños et al., 2013). Por tanto, el metabolismo del paciente quirúrgico implica la intervención de varios estímulos: a nivel del sistema hipotalámico-hipofisiario se induce la producción de adrenocorticotropa, encargada de movilizar ácidos grasos libres (lipolisis), cuando los niveles de cortisol son bajos se aumenta la secreción de la adrenocorticotropa, también se aumenta en estadios de estrés, fiebre, hipoglucemia aguda y las intervenciones quirúrgicas mayores (Díaz & Israel, 2004; Escobar, 2002). El cortisol afecta el metabolismo de los carbohidratos por la estimulación de gluconeogénesis del hígado y la creciente utilización de la glucosa por las células corporales; también estimula la liberación de aminoácidos desde los tejidos extrahepáticos, principalmente músculo y se convierten en glucosa. El cortisol disminuye la respuesta inflamatoria e inmune (Strömmer et al., 1998; Carli et al., 2001). En cuanto a la actividad beta-adrenérgica, se presenta la glucogenólisis muscular, formación del lactato y lipolisis. La estimulación de los receptores alfa produce una glucogenólisis hepática (Thorell et al., 1994; Desborough et al., 2000). El estrés del paciente quirúrgico induce una respuesta neurofisiológica que gobierna las alteraciones endocrinas y metabólicas, que modifican el equilibrio fisiológico en el trauma (Väisänen et al., 2002).
A nivel del metabolismo de los carbohidratos, producto del estrés de la cirugía y la anestesia, se presenta hiperglucemia y glucosuria (Vaquero-Morillo et al., 2014; Allweiler, 2016); además, el aumento en la producción de catecolaminas genera hiperglicemia, puesto que hay una inhibición de la producción pancreática de insulina y de su actividad periférica, por tanto los niveles elevados de glucosa resultan en depresión de la secreción de insulina y aumento en la secreción de glucagón con aparición de hiperglucemia, la liberación de aminoácidos de los músculos y la movilización de ácidos grasos libres a partir del tejido adiposo (Lamarche et al., 1995). Otros factores que contribuyen en la tasa aumentada de la glucosa en sangre pueden ser el desdoblamiento de los carbohidratos periféricos por el cortisol, la movilización de los carbohidratos por la hormona del crecimiento y su efecto antagónico al de la insulina en la periferia y la gluconeogénesis, debido a la liberación de glucagón (Englehart & Schreiber, 2006). El metabolismo de los carbohidratos es más importante en los animales durante la fase inicial del traumatismo, luego cuando se requiere más energía ocurre el desdoblamiento de las grasas y las proteínas (Chandler, 2000). El principal desencadenante hormonal para el catabolismo proteico traumático, probablemente se debe a la liberación de catecolaminas desde la médula adrenal (Van Hoogmoed et al., 1999). El lactato aumenta mucho cuando los tejidos están hipoperfundidos (Schwartz, 1990; Weissman, 1990), además de la duplicación en el ritmo de la gluconeogénesis, lo que se refleja en una mayor producción de glucosa, sirviendo como precursores principales los aminoácidos y el lactato, y en segundo lugar, las grasas y el glicerol (Schwartz, 1990).
Los precursores gluconeogénicos principales para la síntesis hepática de glucosa y en menor grado la renal son el lactato, el glicerol y los aminoácidos como la alanina y la glutamina (Levraut, et al., 1998); las fuentes principales de lactato son: el metabolismo de la glucosa por los eritrocitos y leucocitos que no oxidan esta sustancia; gran parte de células que requieren glucosa como las cerebrales y otros tejidos nerviosos que la metabolizan por completo hasta generar CO2; pero los eritrocitos y leucocitos la convierten en lactato por glucolisis aerobia y liberan el metabolito en la circulación. El hígado convierte el lactato en glucosa, la cual queda de nuevo disponible para su uso en los tejidos periféricos, proceso que corresponde al ciclo de Cori (Odom et al., 2013). La respuesta metabólica al traumatismo quirúrgico incluye niveles plasmáticos incrementados de cortisol, con catecolaminas, glucagón, aldosterona y hormona antidiurética, que aumenta el requerimiento de energía metabólica (Benson et al., 2000; Ko et al., 2000). En el acto quirúrgico se produce una disminución en la presión sanguínea de oxígeno y por tanto disminuye el metabolismo oxidativo, resultando glucolisis anaerobia. La acumulación de ácido láctico y el desarrollo de acidemia láctica se incrementa progresivamente, causando daño intracelular y muerte, en esta etapa en la cual generalmente hay bajo flujo, hipo perfusión e hipoxia, también se presenta elevación del lactado, acidosis metabólica y aumento de los ácidos grasos libres (Demers et al., 2000).
En el presente estudio se miden los niveles de glucosa y lactato de los caninos sometidos a cirugía bajo anestesia general, analizando su correlación y comportamiento durante la primera hora de cirugía.
Materiales y Métodos
Consentimiento informado: Todos los propietarios de los pacientes incluidos en el estudio manifestaron mediante consentimiento informado, su aprobación para la medición de glucosa y lactato durante la primera hora de cirugía, lo anterior previa autorización del comité de ética animal adscrito a la Universidad de Caldas. Tipo de estudio: Descriptivo, analítico, cuantitativo, por el cual se realizó una medición de los niveles de glicemia y lactato durante la primera hora de cirugía, y se analizan las variaciones de los niveles séricos obtenidos.
Pacientes: El estudio se realizó en 19 caninos, de raza criolla entre machos y hembras, clínicamente sanos, con una edad promedio de 19 meses (rango de 7 a 40 meses de edad) y con peso corporal promedio de 15,5kg (rango de 6 a 35kg de peso corporal), fueron llevados por sus propietarios al Hospital Veterinario “Diego Villegas Toro” de la Universidad de Caldas, para realizarles diferentes procedimientos quirúrgicos bajo anestesia general con un ayuno de 8 horas. Durante el examen físico general, todos los pacientes se encontraron en condiciones óptimas de salud, los criterios de inclusión para el estudio fueron: animales completamente sanos, sin ninguna patología de base.
Los animales fueron preanestesiados con acetilpromazina (0.05mg/kg, IM), y se tomó la primera muestra de sangre proveniente de las venas cefálicas o en su defecto de las metatarsianas recurrentes, tomándose por cada paciente una muestra de 0,5 ml de suero y se almacenó en tubos de tapa de color amarillo, el cual sirve para determinaciones en suero y química clínica (este se utilizó en cada etapa de extracción de suero). Quince minutos después del paciente encontrarse anestesiado, previa administración de hidromorfona (0,05 mg/kg, IM) e inducción con ketamina (3mg/kg IV) y propofol (3mg/kg IV); y con mantenimiento del plano profundo de la anestesia a través de isofluorano y con ventilación mecánica (Otero et al., 2004), se realizó la segunda toma de sangre y así sucesivamente cada 15 minutos hasta completar cinco muestras, que representan la primera hora de cirugía. Para cada muestra de sangre se utilizó una nueva jeringa desechable de 1ml. La medición de los niveles de glicemia se realizó con un glucómetro marca Accu-Chek Sensor ® (Laboratorio Roche), con sangre venosa extraída en tubos sin anticoagulante, midiéndose inmediatamente la glicemia en mg/dl (Dillon A, 1997). El lactato fue analizado inmediatamente luego de la obtención de cada muestra, mediante la utilización de un medidor enzimático (Accutrend® Plus, Roche) (Piccione et al., 2012).
Los resultados se dividieron en 5 grupos, tanto para glucosa como para lactato: sin anestesia, con anestesia a los 15, 30, 45 y 60 minutos.
Análisis estadístico
Los resultados fueron analizados a través del programa estadístico IBM SPSS Statistics 23, donde se aceptaba diferencia estadísticamente significativa cuando P valor es < 0,05.
Resultados y Discusión
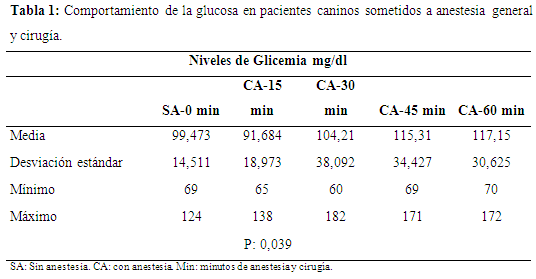
Los niveles de glicemia (mg/dl) de acuerdo con las medias, antes de iniciar la cirugía, presentaron valores de 99,47±14,51 y los sometidos a cirugía bajo efectos de anestesia general, en función del tiempo presentaron los siguientes valores: a los 15 minutos 91,68±18,97, a los 30 minutos 104,21±38,09, a los 45 minutos 115,31±34,42 y a los 60 minutos 117,15±30,62. De acuerdo con el nivel de significación exacta o probabilidad asociada (sig. intergrupos, prueba Anova) es de 0,039, siendo este valor menor a 0,05, se puede afirmar que existen diferencias estadísticamente significativas entre los grupos contrastados, con una confiabilidad del 95%; lo anterior significa que los niveles de glicemia van aumentando en función del tiempo, con valores tendientes a la hiperglicemia. Cabe resaltar que la anestesia general es hiperglucemiante por incrementar la respuesta adrenérgica al glucagón, descompensando al paciente con la consecuente elevación del riesgo quirúrgico (Coppo & Mussart, 2005). Los niveles de referencia para la glucosa en pequeños animales es de 83 a 90 mg/dl, por lo que se sugiere que antes de la cirugía los animales deben estar normoglucémicos y aglucosúricos, lo cual implica una cuidadosa estrategia previa a base de insulina, potasio, ayuno y glucosa (Coppo, 2001) (tabla 1).
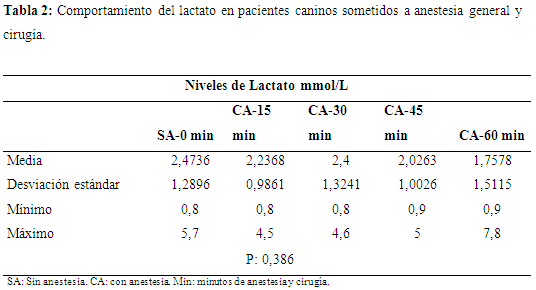
Los niveles de lactato (mmol/L) en los pacientes, antes de iniciar la cirugía, presentaron valores de 2.47±1.2 y los sometidos a cirugía bajo efectos de anestesia general, en función del tiempo presentaron los siguientes valores: a los 15 minutos 2,23±0,98, a los 30 minutos 2,4±1,32, a los 45 minutos 2,02±1,002 y a los 60 minutos 1,7±1,5. De acuerdo con el nivel de significación exacta o probabilidad asociada (sig. intergrupos, prueba Anova) es de 0,386, siendo este valor mayor a 0,05, se puede afirmar que no existen diferencias estadísticamente significativas entre los grupos contrastados, con una confiabilidad del 95%, esto significa que los niveles de lactato en función del tiempo no se ven alterados, además el proceso metabólico con relación al estado de anestesia no genera cambios representativos (tabla 2).
En el presente trabajo se observa que los niveles de glicemia en sangre en relación con el tiempo aumentan, acorde con los resultados de los promedios los niveles más altos de glucosa se presentaron a los 60 minutos después de que el paciente estuvo bajo los efectos de anestesia general y de la incisión quirúrgica.
El comportamiento del lactato durante la intervención quirúrgica tiende a disminuir levemente, sin embargo se compensa, puesto que en un periodo de estrés agudo como lo es la cirugía, existe un aumento en el gasto energético, de allí que las demandas de oxígeno son insuficientes para el músculo en la degradación aeróbica, por tanto se produce la glicólisis anaeróbica muscular, la cual tiene como producto final un compuesto orgánico de tres átomos de carbono, el lactato, el cual se produce en un proceso de reducción donde los electrones del NADH son transferidos directamente al grupo carbonilo del piruvato, con la acción de la piruvato deshidrogenasa, la cual cataliza la reacción (De la Fuente et al., 2005). Como se mencionó, el lactato o ácido láctico es un producto del metabolismo anaeróbico de los carbohidratos y deriva principalmente de las células musculares y glóbulos rojos (Tadich et al., 2003).
En términos generales existe una relación inversa entre el comportamiento de los niveles de glucosa comparados con los niveles de lactato en la primera hora en los pacientes quirúrgicos bajo anestesia general. En el caso de los niveles altos de lactato, se pueden relacionar con estados de hipoxia o anoxia (Weissman, et al 1990), además la concentración plasmática de lactato aumenta en muchas lesiones de manera correlacionada con la gravedad de éstas. La disminución progresiva en los niveles de lactato, corrobora el aumento de la gluconeogénesis hepática en la cual se depuran los valores iníciales del metabolito, encontrándose valores mínimos una hora después de iniciada la cirugía; esto se relaciona con lo postulado por Laiño (1994), quien manifiesta que el lactato es un buen intermediario metabólico entre los depósitos de carbohidratos en forma de glucosa y glucógeno y los productos finales del metabolismo (Allen & Holm, 2008).
Teniendo en cuenta el comportamiento de los niveles de glucosa y los valores de referencia normales en caninos 54,05 a 90,08 mg/dl (Cubillos et al., 2008) en el presente trabajo, como se ha mencionado se observa un progresivo aumento de sus valores séricos con tendencia a la estabilización al final de la primera hora de la anestesia y el procedimiento quirúrgico; ese estado de hiperglicemia se debe también a la acción del cortisol, incrementa la gluconeogénesis hepática, mediante el aumento de la actividad de enzimas responsables de la conversión de aminoácidos en glucosa (Yamada et al., 1993, Méndez y Ramos, 1994). El ritmo de la gluconeogénesis puede duplicarse o aun triplicarse entre lesiones graves, y esto, se refleja en una mayor producción de glucosa, los principales precursores son aminoácidos y lactato y en segundo término las grasas en forma de glicerol (Pierluissi y Campbell, 1981).
Conclusiones
En todos los pacientes se detectó estrés metabólico con la subsecuente elevación de los niveles de glucosa en la primera hora del procedimiento quirúrgico. Teóricamente, los niveles de lactato debieron haber aumentado, sin embargo en el grupo estudiado, los niveles de este metabolito estuvieron dentro de los rangos de normalidad.
Referencias bibliográficas
Allen, S.E.; Holm, J.L. Lactate: physiology and clinical utility. Journal of Veterinary Emergency and Critical Care. 2008: 123-132.
Allweiler, S. How to Improve Anesthesia and Analgesia in Small Mammals. Veterinary Clinics of North America: Exotic Animal Practice. v.19, n.2, p. 361-377, 2016.
Benson, G.J.; Grubb, T.L.; Neff-Davis, C.; et al. Perioperative stress in response in the dog: Effect of pre-emptive administration of medetomidine. Veterinary Surgery, v.29, p.85–91, 2000.
Carli, F.; Phil, M.; Benneth G, J. Pain and postoperative recovery. Anesthesiology, v.95, p.573-4, 2001.
Chandler, M.L.; Guilford, W.G.; Maxwell, A.; et al. A pilot study of protein sparing in healthy dogs using peripheral parenteral nutrition. Res Vet Sci, v.69, p.47-52, 2000.
Coppo JA. Fisiología comparada del medio interno. Ed. Dunken. Buenos Aires, 2001.
Coppo, J.A.; Mussart de Coppo, N.B. Valoración del riesgo anestésico-quirurgico en pequeños animales. REDVET, v.6, n.10, p.1-10, 2005.
Cubillos, V.; López, C.; Alberdi, A. Estudio histopatológico e inmunohistoquímico de páncreas en perros diabéticos inducidos con aloxano. Arch. med. Vet, v.40, n.2, p. 169-177, 2008.
De la Fuente, J.; Díaz, M.T.; Álvarez, I.; et al. Estandarización de las metodologías para evaluar la calidad del producto (animal vivo, canal, carne y grasa) en los rumiantes. INIA, v.14, p.47-60, 2005.
Demers, P.; Elkouri, S.; Martineau, R.; et al. Outcome with high blood lactate levels during cardiopulmonary bypass in adult cardiac operation. AnnThoracSurg, v.70, n.6, p. 2082-6, 2000.
Desborough, J.P. The stress response to trauma and surgery. Br J Anaesth, v.85, p.109-17, 2000.
Díaz, E.; Israel, A. Papel de la aldosterona y las glándulas suprarrenales en la acción renal de la adrenomedulina administrada centralmente. AVFT, v.23, n.2, p. 127-135, 2004.
Dillon, A.; Menard, M.; Newman, R.; et al. Glucometer analysis of one-hour glucose challenge sample. Am.J. Obstet. Gynecol, v.177, n.5, p.1120-1123, 1997.
Englehart, M.S.; Schreiber, M.A. Measurement of acid–base resuscitation endpoints: lactate, base deficit, bicarbonate or what? CurrOpinCritCare, v.12, p.569–74, 2006.
Escobar, I. C. Respuesta fisiológica al estrés anestésico quirúrgico. ActaMédica, v.10, p.1-2, 2002.
Flecknell, P.A.; Thomas, A.A. Comparative anesthesia and analgesia of laboratory animals. Veterinary Anesthesia and Analgesia. 9 ed. Lumb and Jones, 2015. 754–63 p.
Ko, J.C.H.; Mandsager, R.E.; Lange, D.N.; et al. Cardiorespiratory responses and plasma cortisol concentrations in dogs treated with medetomidine before undergoing ovariohysterectomy. Journal of the American Veterinary Medical Association, v. 217, p. 509–514, 2000.
Kutza, J.: Gratz, I.; Afshar, M.; et al. The effects of general anesthesia and surgery on basal and interferon stimulated natural killer activity of humans. AnesthAnalg, v.85, p.918-23, 1997.
Laiño, F.A.; Duperly, J. El Ácido láctico en la Medicina del Deporte. (Revisión). Acta Colombiana de Medicina del Deporte, v.2, 1994.
Lamarche, L.; Yamaguchi, N.; Peronnet, F. Hepatic denervation reduces adrenal catecholamine secretion during insulin-induced hypoglycemia. Am J Physiol, v.268, p.50-7, 1995.
Levraut, J.; Ciebiera, J.P.; Chave, S.; et al. Mild hyperlactatemia in stable septic patients is due to impaired lactate clearance rather than overproduction. Am J RespirCrit Care Med, v.157, p.1021–1026, 1998.
Méndez, D.J.; Ramos, H.G. Animal models in diabetes research. Arch Med Res, v.25, p.367-375, 1994.
Odom, S.R.; Howell, M.D.; Silva, G.S.; et al. Lactate clearance as a predictor of mortality in trauma patients. J Trauma Acute Care Surg, v.74, p. 999–1004, 2013.
Otero, P.; Jacomet, L. Protocolos anestésicos y analgésicos en procedimientos específicos. En: Dolor, evaluación y tratamiento en pequeños animales. 1.ed. Buenos Aires, Argentina: Intermédica, 2004. 259-260 p.
Piccione, G.; Casella, S.; Panzera, M.; et al. Effect of moderate treadmill exercise on some physiological parameters in untrained beagle dogs. ExpAnim, v.61, n.5, p.511-515, 2012.
Pierluissi, J.; Campbell, J. Growth hormone and metasomatotrophic diabetes: effects on insulin and proinsulin of serum and pancreas in dogs. Diabetologia, v.21, p.558-562, 1981.
Regueiro-Purriños, M; Ajenjo, J.M.; De Prado, A.P.; et al. Anestesia en el modelo animal de investigación cardiovascular. Rev Española de Cardiología, v.13, p.47-56, 2013 (suppl. 2)
Schwartz, Seymour I. Principios de cirugía. Respuestas endócrinas y metabólicas a la lesión. 5 .ed. Editorial Interamericana, 1990. 59p.
Strömmer, L.; Permert, J.; Arnelo, U.; et al. Skeletal muscleinsulin resistance after trauma: insulin signaling and glucose transport. Am J Physiol, v.275, p.351-8, 1998.
Tadich, N.; Gallo, C.; Echeverría, R.; et al. Efecto del ayuno durante dos tiempos de confinamiento y de transporte terrestre sobre algunas variables sanguíneas indicadoras de estrés en novillos. Arch Med Vet, v.35, p.171-185, 2003.
Thorell, A.; Effendic, S.; Gutniak, M.; et al. Insulin resistance after abdominal surgery. Br J Surg, v.8, p.59-63, 1994.
Väisänen, M., Raekallio, M., Kuusela, E., Huttunen, P., Leppäluoto, J., Kirves, P., Vainio, O., 2002. Evaluation of the perioperative stress response in dogs administered medetomidine or acepromazine as part of the preanesthetic medication. American Journal of Veterinary Research 63, 969–975.
Van Hoogmoed, L.; Rodger, L.D.; Spier, S.J.; et al. Evaluation of peritoneal fluid pH, glucose concentration, and lactate dehydrogenase activity for detection of septic peritonitis in horses. J Am VetMedAssoc, v.214, p.1032–1036, 1999.
Vaquero-Morillo, F.; Ballesteros-Pomar, M.; Fernández-Morán, M.C.; et al. Modelos animales para el aprendizaje de la cirugía endovascular. Angiología, v.66, n.5, p.254-261, 2014.
Weissman, Charles. The metabolic response to stress: An overview and update; Anesthesiology, v.73, p.308-327, 1990.
Yamada, F.; Inoue, S.; Sayito, T.; et al. Glucoregulatory hormones in the immobilization stress-induced increase of plasma glucose in fasted and fed rats. Endocrinology, v.132, p.2199-2205, 1993.
Como citar: Osorio, J.H.; Quenán, Y.E.; Giraldo-Jiménez, L. Niveles de glucosa y lactato en plasma sanguíneo de caninos durante la primera hora de cirugía. Revista Veterinaria y Zootecnia, v. 9, n. 2, p. 79-89, 2016. DOI: 10.17151/vetzo.2015.9.2.7
Este obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|