|
Identificación de Ehrlichia canis (Donatien & Lestoquard) Moshkovski mediante PCR anidada1
ARTÍCULO DE
(Recibido: marzo 6, 2013 aprobado: abril 30, 2013)
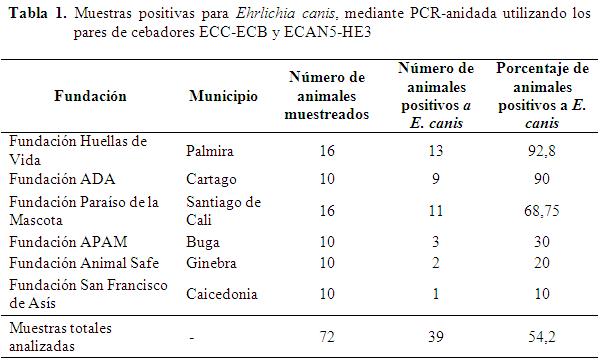
RESUMEN: La ehrlichiosis monocítica canina es una enfermedad multisistémica en la cual la sintomatología no es muy clara, y es ocasionada por la rickettsia Ehrlichia canis, la cual es transmitida por la garrapata Rhipicephalus sanguineus. En esta investigación se determinó la presencia de E. canis, en perros abandonados por sus propietarios y protegidos en hogares de cuidado animal localizados en el departamento del Valle del Cauca, en los municipios de Cali, Palmira, Buga, Ginebra, Caicedonia y Cartago. La identificación molecular se realizó mediante PCR-anidada a partir de ADN extraído de muestras de sangre de animales con antecedentes de contacto con garrapatas y el cual fue amplificado utilizando los pares de cebadores ECC-ECB para la primera reacción y ECAN5-HE3 para la segunda reacción PCR; estos últimos dos pares de cebadores son específicos para la especie E. canis. Las muestras también fueron aleatoriamente analizadas por pruebas serológicas. En todas las zonas muestreadas en el Valle del Cauca, fue detectada Ehrlichia canis, presentándose la mayor prevalencia en los municipios de Palmira y Cartago con 92,8 y 90%, respectivamente. En la ciudad de Santiago de Cali se estableció una prevalencia media de 68,75% y las zonas de baja prevalencia fueron observadas en los municipios de Caicedonia (10%), Ginebra (20%) y Buga (30%). Esta investigación representa el primer registro de la presencia de ehrlichiosis monocítica canina diagnosticada mediante PCR-anidada en el Valle del Cauca, Colombia.
Palabras clave: cebador, enfermedad, molecular, serología
Identification of Ehrlichia canis (Donatien & Lestoquard) Moshkovski using nested-PCR
ABSTRACT: Canine monocytic ehrlichiosis is a multisystem disease in which the symptoms are not very clear, and is caused by the rickettsia Ehrlichia canis, which is transmitted by the Rhipicephalus sanguineus tick. The presence of Ehrlichia canis in dogs found in animal home refuges located in the Department of Valle del Cauca, in the municipalities of Cali, Palmira, Buga, Ginebra, Caicedonia and Cartago was determined. E. canis molecular identification was carried out through nested-PCR from DNA extracted from blood samples of animals with known tick contact, and which was amplified using ECC-ECB choke pairs during the first reaction and ECAN5 and HE3 chokes for the second PCR reaction; these two last choke pairs are specific for the E. canis species. Samples were also randomly analyzed to determine the presence of E. canis through serologic test. Ehrlichia canis was found in all areas sampled in the Department of Valle del Cauca, registering the highest prevalence in the municipalities of Palmira and Cartago, with 92.8 and 90%, respectively. The medium prevalence was observed in Santiago de Cali with 68.75% and low prevalence places such as the municipalities of Caicedonia (10%), Ginebra (20%) and Buga (30%). This research represents the first report of canine monocytic ehrlichiosis diagnosed through nested-PCR in Valle del Cauca, Colombia.
Key words: choke, disease, molecular, serology
Introducción
Las garrapatas son vectores de diferentes tipos de virus, protozoarios y otros microorganismos, dentro de los cuales pueden encontrarse procariotas Gram negativos de los géneros Rickettsiales, Ehrlichia, Anaplasma y Borrelia, los cuales afectan a humanos y animales en diferentes partes del mundo. E. canis (Donatien & Lestoquard) Moshkovski, fue la primera Rickettsiales descrita en perros y es el agente causante de la ehrlichiosis monocítica canina (EMC), la cual presenta una distribución mundial, particularmente en regiones tropicales y subtropicales y la cual es transmitida por garrapatas de la especie Rhipicephalus sanguineus (Gutiérrez et al., 2008; Paraná da Silva et al., 2010; Kelly et al., 2013). Esta bacteria perteneciente a la familia Anaplasmataceae orden Rickettsiales, presenta especial tropismo por monocitos y macrófagos causando infecciones prolongadas y persistentes (Labruna & Machado, 2006; Rar & Golovljova, 2011).
La EMC presenta una manifestación aguda, subaguda y crónica. En las tres fases se observan síntomas como fiebre, postración, esplenomegalia, anemia y trombocitopenia (Labruna & Machado, 2006), los cuales se encuentran asociados a otras patologías y hacen difícil la identificación del agente por pruebas rutinarias sin las debidas ayudas diagnósticas de laboratorio. La fase aguda y subaguda no es muy específica, dado que se puede observar depresión, anorexia, fiebre y pérdida de peso; también pueden presentarse descargas oculares y nasales, disnea, tos y edema en extremidades. Adicionalmente, en un hemograma de rutina puede observarse anemia, trombocitopenia y leucopenia. Para el caso de la forma crónica se caracteriza por una pérdida progresiva de peso, mucosas pálidas y hemorragias leves en mucosas (Woody & Hoskins, 1991; Beaufils, 1997; Breitschwerdt, 1997).
Algunos patógenos relacionados incluyen Ehrlichia ewingii, Ehrlichia chaffeensis, Anaplasma phagocytophilum y Neorickettsia risticii, los cuales presentan similares manifestaciones clínicas y hematológicas en perros (Dawson et al., 1991; Dumler et al., 2001).
En Colombia, la EMC ha sido diagnosticada en diferentes lugares y por diferentes técnicas. Parrado et al. (2003) evaluaron perros en la ciudad de Villavicencio y encontraron alta prevalencia de Ehrlichia spp., aplicando la técnica de ELISA. Benavides & Ramírez (2003), diagnosticaron la enfermedad en un perro de raza labrador en Manizales, mediante prueba inmunoenzimática. Vargas-Hernández et al. (2012), diagnosticaron E. canis en las ciudades de Bogotá, Bucaramanga y Villavicencio, mediante técnicas de reacciones de inmunofluorescencia indirecta (RIFI) y PCR; datos consignados también por Hidalgo et al. (2009) quienes detectaron la especie E. chaffeensis en Villeta (Cundinamarca), mediante RIFI. En el área de desarrollo de esta investigación, Silva-Molano et al. (2008) en Cali, detectaron el patógeno mediante una prueba comercial ELISA. En cuanto a ehrlichiosis en humanos, Ríos et al. (2008) registran E. canis en el departamento de Sucre, aplicando la técnica RIFI. Dicho tipo de análisis también es registrado por otros autores (Wen et al., 1997).
En cuanto al diagnóstico de E. canis y otras enfermedades ocasionadas por microorganismos no cultivables, Vargas-Hernández et al. (2012) registraron que en Colombia el diagnóstico clínico presuntivo todavía se basa en el examen físico del animal, la historia de contacto con garrapatas y observación de los hemoparásitos en extendido de sangre periférica. El perfil hemático no brinda seguridad al clínico al momento de diagnosticar y tratar un paciente, por ello se requiere la utilización de pruebas diagnósticas más sofisticadas y confiables.
Debido a la baja sensibilidad y especificidad de las pruebas comerciales disponibles actualmente, el análisis molecular del microorganismo se convierte en la mejor opción para el diagnóstico preciso de agentes causantes de enfermedad, evitándose reacciones cruzadas con especies o géneros microbianos diferentes que pueden reaccionar positivamente con pruebas serológicas (Wen et al., 1997; Murphy et al., 1998). Las técnicas basadas en PCR, son más sensibles para la determinación de organismos pertenecientes al género Ehrlichia. Las técnicas inmunoenzimáticas utilizando anticuerpos monoclonales son altamente específicas y sensibles, pero con ellas pueden presentarse reacciones cruzadas que dificultan el diagnóstico preciso del patógeno; lo anterior, representa una desventaja frente a los métodos moleculares de diagnóstico, los cuales pueden detectar específicamente la especie de Ehrlichia, antes o después de inmunoprofilaxis o antibioticoterapias. Dentro de las técnicas basadas en PCR, la PCR-anidada ha sido registrada como una técnica sensible para la detección de E. canis, evitando adicionalmente las reacciones cruzadas que han sido observadas con otras especies de Ehrlichia (Wen et al., 1997; Murphy et al., 1998).
El objetivo principal de esta investigación, fue identificar mediante PCR-anidada la rickettsia E. canis, agente causante de ehrlichiosis canina en el Valle del Cauca (Colombia), a partir de muestras de sangre de perros encontrados en refugios de animales abandonados, ubicados en los municipios de Santiago de Cali, Palmira, Buga, Ginebra, Caicedonia y Cartago. Adicionalmente, se colectaron las garrapatas encontradas en cada animal evaluado, determinando su especie y densidad poblacional.
Materiales y Métodos
Área de estudio
Las muestras fueron tomadas de perros encontrados en refugios y centros de adopción de animales rescatados del maltrato y abandono de la calle; autorizando cada entidad la toma de muestras y la inspección de garrapatas sobre el cuerpo de los animales. Los sitios seleccionados para muestreo fueron los refugios que presentaron mayor concentración de animales y que se encontraban constituidos como fundaciones en el departamento del Valle del Cauca. Por la fluctuación de las poblaciones de animales en estos refugios y las condiciones de salud de los mismos, se tomaron muestras al azar de mínimo el 10% de los animales presentes en ese momento, por refugio y de cada uno, se registró la historia clínica y su condición de salud. De la Fundación Huellas de Vida, ubicada en el corregimiento del Bolo, municipio de Palmira (3°28’47,59” N - 76°18’55,90” O) fueron muestreados 16 animales; de la Fundación Paraíso de la Mascota, ubicada en Santiago de Cali (3°20’21,61’’ N - 76°32’17,60’’ O), se muestreó sangre de 16 animales. De la Asociación Protectora de Animales y Medio Ambiente (APAM), ubicada en el municipio de Buga (3°53’35,98’’ N - 76°17’32,75’’ O), se muestrearon 10 animales. De la Fundación Animal Safe, ubicada en Ginebra (3°42’10,94’’ N - 76°17’35,43’’ O), se muestrearon 10 animales. De la Asociación Defensora de Animales (ADA) del municipio de Cartago (4°42’01,03’’ N - 75°55’52,22’’ O) se colectaron muestras de 10 animales, y de la Fundación de esterilización y protección animal San Francisco de Asís, ubicada en el municipio de Caicedonia (4°20’21,97’’N - 75°49’45,47’’ O), se muestrearon 10 animales.
Toma de muestras de sangre y colecta de garrapatas
Para la toma de muestras de sangre, se realizó el manejo de los caninos de acuerdo con los protocolos necesarios para evitar el sufrimiento animal. La muestra de sangre estuvo comprendida entre 3 y 5 ml por perro, se tomó de la vena cefálica de miembro anterior derecho, con agujas descartables y envases Vacutainer con EDTA (Vacutainer™). Después de la evaluación hematológica las muestras de sangre fueron refrigeradas para su posterior uso en los ensayos de PCR. De los animales muestreados, se colectaron las garrapatas presentes y se almacenaron en viales que contenían alcohol (70%); posteriormente se utilizó un estereomicroscopio para la identificación taxonómica de los individuos colectados, utilizando las claves de López (1980), Barros-Battesti et al. (2006), Osorno-Mesa (2006),Voltzit (2007).
Evaluación hematológica
La determinación del hematocrito se realizó de acuerdo a los protocolos establecidos (Wallerstein, 1987; NCCLS, 2000), definiendo el porcentaje de volumen de la sangre que ocupan los glóbulos rojos. El método implementado para la determinación del hematocrito fue la centrifugación de sangre con anticoagulante EDTA en un tubo micro capilar a 10.000 rpm por 5 minutos (NCCLS, 2000).
Análisis serológico para la determinación de E. canis
En los sitios seleccionados para la realización de los muestreos, la sangre a utilizarse para el análisis molecular fue colectada aleatoriamente del 10% de los animales refugiados en las Fundaciones al momento del muestreo; posteriormente, y de acuerdo a la disponibilidad de pruebas en el laboratorio y número de muestras colectadas en cada sitio, se seleccionó el 25% de las muestras para realizar en ellas análisis serológicos, utilizando las pruebas comerciales Canine SNAP® 4Dx™ (Laboratorios IDEXX), para las cuales registra el fabricante una especificidad de 100% y sensibilidad del 96,2% en la detección de E. canis; cada prueba fue realizada siguiendo las recomendaciones del fabricante.
Extracción de ADN total
Para la extracción de ADN se evaluaron dos métodos con el objetivo de determinar la calidad y concentración de la molécula obtenida por cada uno de ellos, y su posterior amplificación mediante los pares de cebadores para la PCR-1 y PCR-anidada. En el primer método de extracción, se utilizó el kit QIAamp ADN Blood Mini (Qiagen®), en el cual se siguieron las recomendaciones del fabricante (Barbosa et al., 2007; Nakaghi et al., 2008). El segundo método, consistió en una micro-extracción de ADN total por el método Salting out (Sambrook et al., 1989). El ADN total extraído de las 72 muestras, fue almacenado a -20°C y para la visualización, se separaron en un gel de agarosa (0,8% p/v, gel de 15 cm de ancho por 10 cm de largo), adicionado con bromuro de etidio (1,0 mg/ml), y buffer TBE (Trizma Base, Ácido Bórico, EDTA), a una concentración final de 0,5X; en la electroforesis se incluyó un marcador de peso molecular de 100 pb (Bioline®); la electroforesis se realizó a 80 voltios por 1 h y las bandas se visualizaron en un transiluminador ultravioleta (Eagle Eye II Strategene®).
PCR-anidada para la determinación de E. canis
Para la detección específica de E. canis, a partir de sangre de animales con síntomas de la enfermedad o con antecedentes de contacto con garrapatas, han sido diseñados dos pares de cebadores que amplifican el ADNr 16S; el primer par de cebadores ECC y ECB, utilizados para la primera reacción de PCR, amplifican para el género Ehrlichia y adicionalmente para otras procariotas como Anaplasma spp. y E. coli. Una vez amplificada esta región del ADN, esta se utilizó como plantilla para la segunda PCR (o PCR-anidada) en la cual se acoplaron los cebadores ECAN5 y HE3, los cuales son específicos para la especie E. canis (Murphy et al., 1998; Gutiérrez et al., 2008; Vargas-Hernández et al., 2012).
Inicialmente se tomaron alícuotas de 2 µl de ADN, las cuales se utilizaron para la amplificación de un segmento de la región 16S del ARNr que corresponde a las especies de Ehrlichia y otras procariotas como Rickettsia spp., Anaplasma spp. y E. coli (Dawson et al., 1994); el amplificado resultante, fue sometido nuevamente a amplificación (PCR-anidada), con un segundo par de cebadores específicos para la especie E. canis (Wen et al., 1997; Murphy et al., 1998; Barbosa et al., 2007; Gutiérrez et al., 2008; Nakaghi et al., 2008).
La primera reacción de PCR, se realizó en un volumen total de 20 µl, conteniendo Buffer Taq (BIOLASE™ DNA Polymerase, Bioline) 10x NH4 [160 mM (NH4)2SO4, 670 Tris-HCl pH 8,0, 0,1% Tween-20] a una concentración final de 1X/µl; 0,2 mM de cada uno de los dNTPs; 0,25 µM de cada uno de los cebadores ECC (5´ AGA ACG AAC GCT GGC GGC AAG CC 3´) y ECB (5´ CGT ATT ACC GCG GCT GCT GGC 3´) (Dawson et al., 1994); 1,5 mM de MgCl2, 20 ng/µl de ADN; agua tipo HPLC esterilizada a través de un filtro de membrana de 0,22 µm de tamaño de poro (MILLEX®-GV; Millipore Products Division, Bedford, MA) y autoclavada por 30 min/121°C/15 lb de presión; y 0,5 U/µl de Taq Polimerasa.
La reacción de PCR-anidada, se llevó a cabo bajo las mismas condiciones de la primera PCR. Para esta PCR, el amplificado de la primera se diluyó en proporción 1:30 en agua tipo HPLC esterilizada y posteriormente, 1 µl de esta dilución se tomó como plantilla para ser amplificada con el segundo par de cebadores ECAN5 (5´ CAA TTA TTT ATA GCC TCT GGC TAT AGG A 3´) y HE3 (5´ TAT AGG TAC CGT CAT TAT CTT CCC TAT 3´) específicos para la especie E. canis (Murphy et al., 1998; Nakaghi et al., 2008; Vargas-Hernández et al., 2012). Para los dos ciclos de PCR fueron utilizados controles positivos y negativos, compuestos por E. canis, ADN humano y cóctel de reacción PCR. El perfil térmico para la amplificación con el primer par de cebadores, se realizó en 35 ciclos con una denaturación inicial a 94°C/1 min y denaturación por ciclo a 94°C/30 segundos; la hibridación de los cebadores ECC y ECB se realizó a 68°C/2 min con una extensión a 72°C/2 min y una extensión final a la misma temperatura por un tiempo de 5 minutos. El perfil térmico para los cebadores ECAN5 y HE3, consistió de 37 ciclos con una denaturación inicial a 94°C/1 min y denaturación por ciclo a la misma temperatura por 30 segundos. La hibridación de los cebadores, se realizó a 60°C/2 min, con una extensión por ciclo a 72°C/1,5 min y un extensión final a la misma temperatura por 5 minutos. Los productos resultantes de las dos amplificaciones (PCR-1 y PCR-anidada) se separaron en geles de agarosa 1,5%, buffer TBE 0,5X (Trizma Base, Ácido Bórico, EDTA 0,5 M), bromuro de etidio (1,0 mg/ml), 90V/3 h y se visualizaron bajo un transiluminador de luz ultravioleta (Eagle Eye II Strategene®). El tamaño de las bandas se calculó por comparación con un marcador de 100 pb de DNA (Bioline®, USA).
Resultados y Discusión
En las extracciones de ADN se utilizaron paquetes comerciales y se evaluó el método de extracción Salting out, observándose en los dos el mismo resultado en cuanto a integridad del ADN, concentración y productos de la amplificación con los dos pares de cebadores. De las muestras analizadas en el primer PCR utilizando los cebadores ECC-ECB acoplados, se observó la amplificación de una banda de aproximadamente 483 pb en el 54,2% de las muestras (39 individuos), la cual amplifica para el género Ehrlichia y otras procariotas como Anaplasma spp. y Escherichiacoli (Dawson et al., 1994). En la PCR-anidada utilizando los cebadores especie-específicos para E. canis (ECAN5 y HE3) se observó una banda de aproximadamente 388 pb en el 54,2% de las muestras (39 individuos), la cual es específica para esta especie de Rickettsia (Barbosa et al., 2007; Gutiérrez et al., 2008; Nakaghi et al., 2008). El testigo positivo también amplificó las dos bandas de los mismos pesos en ambas reacciones de PCR (Tabla 1). Según lo registrado por otros autores, estos amplificados con sus respectivos pesos moleculares observados en la electroforesis, son indicativo de la presencia de E. canis en las muestras analizadas (Dawson et al., 1994; Nakaghi et al., 2008).
En este estudio empleando PCR-anidada se determinó la presencia de E. canis en todas las zonas muestreadas del Valle del Cauca; presentándose zonas con alta prevalencia en los municipios de Palmira (92,8%) y Cartago (90%), prevalencia media en la ciudad de Santiago de Cali 68,75% y zonas de baja prevalencia en los municipios de Buga (30%), Ginebra (20%) y Caicedonia (10%).
Relacionando los resultados de los análisis serológicos y moleculares, fueron detectados cuatro animales procedentes de los refugios Animal Safe (Ginebra), APAM (Buga), y Huellas de Vida (Palmira), con síntomas típicos de EMC y los cuales reaccionaron positivamente al análisis serológico, pero negativamente al análisis molecular. Este comportamiento puede ser atribuido al uso preventivo de antibióticos de tipo doxiciclinas o tetraciclinas, los cuales son los agentes terapéuticos de elección en cuadros asociados a EMC (Eddlestone et al., 2007; McClure et al., 2010); procedimiento que fue observado en los refugios visitados, en animales con síntomas de la enfermedad, pero en los que con frecuencia no hay un diagnóstico de laboratorio para verificar la presencia del patógeno. Sumado a lo anterior, la exposición al vector en estos hogares es alta por el flujo constante de animales rescatados. De acuerdo a lo mencionado, el tratamiento administrado a los animales condujo a la eliminación del patógeno, por lo que este no es detectado mediante PCR, pero los anticuerpos contra él siguen siendo producidos por el animal y son detectados por serología (Wen et al., 1997; Lakshmanan et al., 2007; Hegarty et al., 2009). Cabe resaltar que la importancia de las pruebas serológicas radica en el hecho de que estas permiten hacer análisis epidemiológicos retrospectivos de la exposición previa al hemoparásito, lo cual permitiría analizar más objetivamente los resultados del diagnóstico molecular.
Al relacionar los animales positivos a EMC con su hematocrito, se observó que 16,6% de los animales positivos, mostraron un nivel de hematocrito en estado normal, lo que se puede atribuir a que la enfermedad se encuentra en un estado subagudo o crónico (Benavides & Ramírez, 2003), siendo el animal positivo y no evidenciando los signos clínicos de depresión, letargia, anorexia, linfoadenopatía, esplenomegalia, petequias o hemorragias que se pueden encontrar en la enfermedad aguda (Harrus & Waner, 2011). Estos animales podrían estar actuando como portadores asintomáticos del patógeno en áreas endémicas y como diseminadores de la enfermedad (Lanza-Perea et al., 2009). De igual manera, no es posible asegurar qué porcentaje de los animales PCR y SNAP positivos sanos podrían desencadenar una efectiva respuesta inmune que elimine la infección o cuántos caninos podrían continuar como portadores y diseminadores. Esto solo puede ser posible desarrollando protocolos basados en evidencias que confirmen el estado de salud de las poblaciones después de los tratamientos y el constante monitoreo de los animales positivos en el tiempo (Lanza-Perea et al., 2009).
En cuanto a la relación de la enfermedad y la presencia del vector, Ehrlichia canis estuvo asociada con la presencia de uno a tres individuos entre ninfas y adultos de R. sanguineus sobre el cuerpo de los animales muestreados, especialmente en los municipios de Palmira y Buga; esta baja exposición a los vectores puede explicarse por los tratamientos acaricidas preventivos que son realizados constantemente en los refugios para control de la población de garrapatas; pero se debe subrayar que, a pesar de la baja población de vectores, la prevalencia registrada en este estudio es alta, comparado con otros reportes (Kelly et al., 2013).
Rutinariamente en Colombia, el diagnóstico de Ehrlichia ha estado fundamentado en la detección de inclusiones intracitoplasmáticas (mórulas) en monocitos o en neutrófilos mediante el empleo de extendidos de sangre periférica teñidos por la técnica de Giemsa o Wright; este es un método rápido, pero generalmente solo un pequeño porcentaje de polimorfonucleares se encuentran infectados y estos pueden ser observados en las primeras semanas de la enfermedad. Las mórulas no se observan después de 24 a 72 horas de iniciado el tratamiento con doxiciclina y solo son detectadas en un 10 a 75% de los casos clínicos asociados a Ehrlichia, haciendo que el diagnóstico sea bastante limitado (CFSPH, 2013). A diferencia de la PCR-anidada ARNr-16S, para la cual se ha registrado una confiabilidad del 63,1% (Mylonakis et al., 2003), evitando falsos negativos, falsos positivos y respuestas cruzadas con otras especies de Ehrlichia, como las especies E. chaffeensis y E. ewingii (Wen et al., 1997; Vargas-Hernández et al., 2012).
De acuerdo a la información molecular obtenida con este trabajo, se observa que la alta prevalencia de E. canis en el departamento del Valle del Cauca, puede ser debida a las condiciones de abandono y condiciones sanitarias deficientes en las cuales se encuentran estos animales, los cuales son rescatados de las calles o de zonas rurales; adicionalmente, estos resultados de alta prevalencia contrastan con lo hallado por Vargas-Hernández et al. (2012), quienes registran una prevalencia de 40,6% de E. canis, diagnosticada mediante PCR en Colombia en los departamentos de Cundinamarca, Meta y Santander.
Conclusiones
El análisis molecular aplicando la técnica de PCR-anidada, utilizando en la primera reacción de PCR los cebadores universales 16S (procariotas) y en la segunda reacción el par de cebadores especie-específicos para la especie E. canis, permite detectar específicamente la especie asociada a EMC, evitando falsos positivos que pueden presentarse por el uso de análisis serológicos, en los cuales se observan reacciones positivas frente a otras especies de Ehrlichia.
Agradecimientos
Los autores agradecen la colaboración de la Bióloga Ana María Echeverry Ospina, del Laboratorio de Fitopatología de la Universidad Nacional de Colombia sede Palmira y de las Fundaciones que permitieron el ingreso para el diagnóstico y toma de muestras.
Referencias Bibliográficas
· Barbosa Sanchez, I.X.; Oviedo Socarras T.J.; Ladino Silva, M. et al. Apoptose na infecçâo experimental de caes domésticos com Ehrlichia canis. Ciência Rural, Santa Maria, v.42, n.8, p.1457-1463, 2007. · Barros-Battesti, D.M.; Arzua, M.; Bechara, G.H. Carrapatos de importância médico-veterinária da Região Neotropical: Um guia ilustrado para identificação de espécies. 1.ed. São Paulo, Brasil: Editorial Vox, 2006. 223p. · Beaufils, J.P. Ehrlichiosis: Clinical aspects in dogs and cats. International Forum on Ticks and Tick-Borne Disease, Compendium on Continuing Education for the Practicing Veterinarian, v.19, p.57-61, 1997. · Benavides, J.A.; Ramírez, G. Ehrlichiosis canina. Revista Colombiana de Ciencias Pecuarias, v.16, n.3, p.268-274, 2003. · Breitschwerdt, E.B. Ehrlichiosis: One or many diseases? A supplement to Compendium on Continuing Education for the Practicing Veterinarian, v.19, p.62-63, 1997. · Centre for Food Security and Public Health –CFSPH–. Ehrlichiosis and Anaplasmosis: Zoonotic Species. Iowa State University, 2013. Disponible en: http://www.cfsph.iastate.edu/Factsheets/pdfs/ehrlichiosis.pdf Accesado en: 01/08/2013. · Dawson, J.E.; Anderson, B.; Fishbein, D. et al. Isolation and characterization of an Ehrlichia sp. from a patient diagnosed with human ehrlichiosis. Journal of Clinical Microbiology, v.29, n.12, p.2741-2745, 1991. · Dawson, J.E.; Stallknecht, D.E.; Howerth, E.W. et al. Susceptibility of white-tailed deer (Odocoileus virginianus) to infection with Ehrlichia chaffeensis, the etiologic agent of human ehrlichiosis. Journal of Clinical Microbiology, v.32, n.11, p.2725-2728, 1994. · Dumler, J.S.; Barbet, A.F.; Bekker, C.P. et al. Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and ‘HGE agent’ as subjective synonyms of Ehrlichia phagocytophila. International Journal of Systematic and Evolutionary, v.51, p.2145-2165, 2001. · Eddlestone, S.M.; Diniz, P.P.; Neer, T.M. et al. Doxycycline clearance of experimentally induced chronic Ehrlichia canis infection in dogs. Journal of Veterinary Internal Medicine, v.21, n.6, p.1237-1242, 2007. · Gutiérrez, C.N.; Martínez, M.; Sánchez, E. et al. Cultivation and molecular identification of Ehrlichia canis and Ehrlichia chaffeensis form a naturally con-infected dog in Venezuela. Veterinary Clinical Pathology, v.37, n.3, p.258-265, 2008. · Harrus, S.; Waner, T. Diagnosis of canine monocytotropic ehrlichiosis (Ehrlichia canis): an overview. Veterinary Journal, v.187, n.3, p.292-296, 2011. · Hegarty, B.C.; De Paiva Diniz, P.P.; Bradley, J.M. et al. Clinical relevance of annual screening using a commercial enzyme-linked immunosorbent assay (SNAP 3Dx) for canine ehrlichiosis. Journal of the American Animal Hospital Association, v.45, n.3, p.118-124, 2009. · Hidalgo, M.; Vesga, J.F.; Lizarazo, D. et al. Short Report: A Survey of Antibodies against Rickettsia rickettsii and Ehrlichia chafeensis in Domestic Animals from a Rural Area of Colombia. The American Journal of Tropical Medicine and Hygiene, v.80, n.6, p.1029-1030, 2009. · Kelly, P.J.; Xu, C.; Lucas. H.; Loftis, A. et al. Ehrlichiosis, Babesiosis, Anaplasmosis and Hepatozoonosis in dogs from St. Kitts, West Indies. PLoS One, v.8, n.1, p.1-10, 2013. · Labruna, M.B.; Machado, R.Z. Agentes transmitidos por carrapatos na Regiao Neotropical. En: Barros-Batesti, D.M.; Arzua. M.; Bechara, G.H. (Eds.). Carrapatos de importância médico-veterinária da Região Neotropical: Um guia ilustrado para identificação de espécies. São Paulo: Vox/ICTTD/Butantan, 2006. p.155-162. · Lakshmanan, B.; John, L.; Gomathinayagam, S. et al. Molecular detection of Ehrlichia canis from blood of naturally infected dogs in India. Veterinarski arhiv, v.77, n.4, p.307-312, 2007. · Lanza-Perea, M.; Kumthekar-Sachin, M.; Sabarinath, A. et al. Doxycycline treatment of asymptomatic dogs seropositive for Ehrlichia canis. West Indian Veterinary Journal, v.9, n.2, p.11-13, 2009. · López, G. Bioecología y distribución de garrapatas en Colombia. En: Control de garrapatas. Medellín: Instituto Colombiano Agropecuario, Compendio No. 39, 1980. p.33-43. · McClure, J.C.; Crothers, M.L.; Schaefer, J.J. et al. Efficacy of a doxycycline treatment regimen initiated during three different phases of experimental ehrlichiosis. Antimicrobial Agents and Chemotherapy, v.54, n.12, p.5012-5020, 2010. · Mylonakis, M.E.; Koutinas, A.F.; Billinis, C. et al. Evaluation of cytology in the diagnosis of acute canine monocytic ehrlichiosis (Ehrlichia canis): a comparison between five methods. Veterinary Microbiology, v.91, n.2-3, p.197-204, 2003. · Murphy, L.S.; Ewing, L; Whitworth, J. et al. A molecular and serologic survey of Ehrlichia canis, E. chaffensis and E. ewingii in dogs and ticks from Oklahoma. Veterinary Parasitology, v.79, n.4, p.325-339, 1998. · Nakaghi, A.C.; Zacarias-Machado, R.; Tinucci Costa, M. et al. Canine ehrlichiosis: clinical, hematological, serological and molecular aspects. Ciência Rural, Santa Maria, v.38, n.3, p.766-770, 2008. · National Committee for Clinical Laboratory Standards –NCCLS–. Procedure for Determining Packed Cell Volume by the Microhematocrit Method; Approved. 3.ed. Standard. 2000. 7p. · Osorno-Mesa, E. Las garrapatas de la República de Colombia. Revista del Instituto Nacional de Salud Biomédica, v.26, n.3, p.317-36, 2006. · Paraná da Silva, B.M.; Leal, D.C.; Portela Medina Barboza, D.C. et al. Prevalence of ehrlichial infection among dogs and ticks in Northeastern Brazil. Revista Brasileira de Parasitologia Veterinária, v.19, n.2, p.89-93, 2010. · Parrado, M.; Vargas, F.; Hernández, G. et al. Asociación de los resultados de una prueba serológica (ELISA) y frotis sanguíneo en caninos con sintomatología compatible de Ehrlichiosis. Orinoquía, v.7, n.1-2, p.6-11, 2003. · Rar, V.; Golovljova, I. Anaplasma, Ehrlichia, and “Candidatus Neoehrlichia” bacteria: pathogenicity, biodiversity, and molecular genetic characteristics, a review. Infection, Genetics and Evolution, v.11, n.8, p.1842-1861, 2011. · Ríos, R.; Franco, S.; Mattar, S. et al. Seroprevalencia de Leptospira sp., Rickettsia sp. y Ehrlichia sp. en trabajadores rurales del departamento de Sucre, Colombia. Asociación Colombiana de Infectología, v.12, n.2, p.319-324, 2008. · Sambrook, J., Fritsch, E.F.; Maniatis, T. Molecular Cloning: A Laboratory manual. 2.ed. N.Y.: Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, 1989. 1659p. · Silva-Molano, R.F.; Sánchez-Ucrós, N.; Loaiza-Echeverri, A.M. Remove from marked records recurrence report of Ehrlichia canis in dog blood samples in Cali, Colombia. Veterinaria y Zootecnia, v.2, n.1, p.27-31, 2008. · Vargas-Hernández, G.; André, M.R.; Faria, J.L. et al. Molecular and serological detection of Ehrlichia canis and Babesia vogeli in dogs in Colombia. Veterinary Parasitology, v.186, p.254-260, 2012. · Voltzit, O.V. A review of Neotropical Amblyomma species (Acari: Ixodidae). Acarina, v.15, n.1, p.3-134, 2007. · Wallerstein, R.O. Laboratory evaluation of anemia. Western Journal of Medicine, v.146, n.4, p.443-451, 1987. · Wen, B.; Rikihisa, Y.; Mott, J.M. et al. Comparison of nested PCR with immunofluorescent-antibody assay for detection of Ehrlichia canis infection in dogs treated with doxycycline. Journal of Clinical Microbiology, v.35, n.7, p.1852-1855, 1997. · Woody, B.J.; Hoskins, J.D. Ehrlichial disease of dogs. The Veterinary Clinics of North America, Small Animal Practice, v.21, n.1, p.75-98, 1991.
1 Investigación financiada con fondos de la Vicerrectoría de Investigación de la Universidad Nacional de Colombia sede Palmira.
Rojas-Triviño, A.; Rueda-Hurtado, A.; Díaz-Molano, D.M.; Mesa-Cobo, N.C.; Benavides-Montaño, J.A.; Imbachi-López, K.; Álvarez-Ríos, L.; López-Bermúdez, R. Identificación de Ehrlichia canis (Donatien & Lestoquard) Moshkovski mediante PCR anidada. Veterinaria y Zootecnia, v.7, n.1, p.x-x, 2013.
<http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=128> |