|
Rinosinusitis crónica felina por Pseudomona aeruginosa, reporte de caso
ARTÍCULO CORTO
(Recibido: enero 15, 2013 aprobado: marzo 20, 2013)
RESUMEN: Una hembra felina, mestiza de pelo corto, que llegó a consulta a la Clínica Veterinaria de Antioquia, con presencia de rinorrea mucopurulenta por fosa nasal derecha, de 6 meses de evolución, sin mejoría a la terapia antibiótica y compatible con una cuadro de rinosinusitis crónica felina, fue sometida a radiografía de cráneo, con cambios en la densidad y radioopacidad del seno frontal derecho y la cavidad nasal derecha, se realizó cultivo y antibiograma, con presencia de Pseudomona aeruginosa. El paciente fue sometido a trepanación del seno frontal derecho y terapia con ceftriaxona 25 mg/kg intravenosa cada 12 horas por 7 días. El paciente después de una semana de tratamiento fue dado de alta con hemograma que comprobó la mejoría. Debido a la menor frecuencia de la P. aeruginosa en los cuadros de rinosinusitis crónica felina se reporta el presente caso, por la menor respuesta a la terapia convencional y por el riesgo zoonótico que representa para la salud pública.
Palabras clave: bacteria, fiebre, nasal, rinorrea, trepanación
Feline chronic rhinosinusitis caused by Pseudomonas aeruginosa. Case report
ABSTRACT: A female short hair mongrel cat, who came for consultation to the Veterinary Clinic of Antioquia, with presence of 6 months evolution of mucopurulent rhinorrhea through right nostril, with no improvement to antibiotic therapy and compatible with a chronic rhinosinusitis feline rhinosinusitis, underwent skull radiography with changes in density and opacity within the right frontal sinus and right nasal cavity; culture and sensitivity was performed, with the presence of Pseudomonas aeruginosa. The patient underwent right frontal sinus trephination and therapy with 25 mg/kg ceftriaxone intravenous injection every 12 hours during 7 days. After one week treatment the patient was discharged with a blood test that confirmed the improvement. Due to the fewer frequency of P. aeruginosa profiles in feline chronic rhinosinusitis this case is reported because of the lower response to conventional therapy and for the zoonotic risk posed to public health.
Key words: bacterium, fever, nasal, rhinorrhea, trepanation
Introducción
La enfermedad respiratoria superior crónica (ERSC) o rinosinusitis crónica felina (RCF), tiene como característica la presencia de estornudos y ruidos respiratorios, que responden poco a la terapia antimicrobiana, considerándose uno de los problemas clínicos más frustrantes para los propietarios (August, 2008). Algunas de las explicaciones del comportamiento de esta enfermedad son: la multicausalidad de la enfermedad, el manejo de estornudos con terapia antibiótica no especifica, el cambio de la flora de las vías respiratorias superiores, ausencia de la terapia quirúrgica y dificultad de la terapia a largo plazo en felinos.
La etiología de la RCF es multicausal (Greene, 2012), se ha reportado como factor predisponente la infección por el herpesvirus felino-1 (HVF-1) (Lara, 2012), que con frecuencia se caracteriza por estados de conjuntivitis, rinitis, fiebre, anorexia y malestar general (August, 2008). Se ha descrito que infecciones con calicivirus felino (CVF), también pueden llevar a la enfermedad (Greene, 2012), pero esta forma menos intensa es menos frecuente (Ettinger & Feldman, 2007).
Los signos clínicos de la ERSC, dependen de diversos factores como la dosis del agente infectante, la cepa, el estado general de salud y la naturaleza de la flora oportunista; dentro de los signos más frecuentes los pacientes presentan: letargo, fiebre, estornudos, conjuntivitis, exudado ocular, tos, exudado nasal e inapetencia (Cohn, 2011; Greene, 2012); aunque se ha descrito la presencia de lesiones orales, sordera y deformación nasal y/o oral (August, 2008; Cohn, 2011; Greene, 2012).
Dentro del grupo de microorganismos aislados en estos pacientes se han descrito: Chlamydophila felis, Bordetella bronchiseptica (Cohn, 2011; Greene, 2012; Lara, 2012), Mycoplasma spp., Cryptococcusneoformans, Staphylococcus spp., Streptococcus spp. y Pasteurella multocida (Ramsey, 2000). Para algunos autores como Bahr (2008), la presencia de P. aeruginosa, es más frecuente que los hallazgos de otros autores donde solo representa el 13%, comparado con el 23% para el Staphylococcus spp. y el 31% para Pasteurella multocida (Stein & Lappin, 2001; Bahr, 2008). En un estudio realizados en Estados Unidos en el 2010, con 4772 gatos sometidos a PCR, se encontró que el 41,8% tenían Mycoplasma felis, 10% B. bronchiseptica y 8,1% C. felis (Cohn, 2011).
El reconocimiento de la presencia de P. aeruginosa, como agente perpetuador de la infección en la cavidad nasal y el consecuente secuestro en los senos frontales, es muy importante para entender por qué los pacientes no responden a la terapia antibiótica y cómo se debe buscar otra estrategia terapéutica para estos pacientes.
La P. aeruginosa es un bacteria Gram negativa, con una pared celular ácido resistente, presenta una resistencia intrínseca a muchos grupos de antibióticos. Esto dado por la antibioterapia indiscriminada, que selecciona las bacterias resistentes y los propios mecanismos genéticos para adquirir esa resistencia (Escribano et al., 2009). Se ha encontrado que este germen es resistente a los betalactamicos, cefalosporinas de primera y segunda generación, cloranfenicol y tetraciclinas, siendo sensible a las cefalosporinas de tercera y cuarta generación, aminoglucósidos (amikacina y gentamicina) y quinolonas (Cabrera-García, 2010), aunque se ha descrito que P. aeruginosa ha demostrado resistencia a la enrofloxacina en 84% (Escribano et al., 2009).
La presencia de exudado nasal con P. aeruginosa, debe ser un llamado de atención en la salud pública, manteniendo estos pacientes en aislamiento total (August, 2008), debido al riesgo zoonótico y a la alta resistencia del germen a la terapia antibiótica.
Evaluación del paciente
Anamnesis: Un paciente felino, hembra, de raza mestiza, de cinco años de edad, con un peso de 3 kg, con vacunación actual contra: rinotraqueitis infecciosa felina, panleucopenia felina, calicivirus, rabia y leucemia felina. Fue llevado a la Clínica Veterinaria de Antioquia (Medellín, Colombia). Con historia de rinorrea serosa en la fosa nasal derecha de evolución de seis meses, tratado con terapia antibiótica (amoxicilina, ampicilina y enrofloxacina) y mucolíticos, sin evolución clínica satisfactoria.
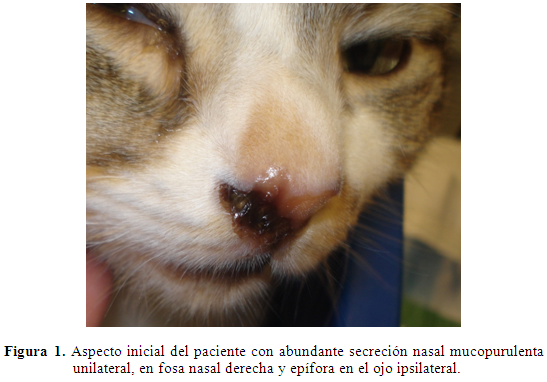
Hallazgos al examen clínico: Al examen clínico, el paciente presentaba secreción nasal mucopurulenta unilateral, en la fosa nasal derecha (Figura 1), linfadenitis retrofaringea, halitosis, gingivitis y ruido inspiratorio de tipo estertor, con disnea inspiratoria; temperatura 39,8°C, frecuencia cardiaca 145 ppm, frecuencia respiratoria 56 rpm, pulso 150 ppm, fuerte, rítmico y con arco alto, reflejo tusígeno positivo, palmo percusión negativa, epífora unilateral en el ojo ipsilateral de la secreción nasal; el paciente no estaba deshidratado, pero presentaba hiporexia de 48 horas de evolución.
Manejo clínico inicial: El paciente fue canalizado en la vena cefálica externa izquierda y se le suministró solución salina 0,9%, en la vena cefálica externa, con dosis de mantenimiento de 60 ml/kg/día; se aplicó por vía intramuscular bromhexina 4 mg cada 12 horas, para el manejo de la secreción nasal, adicionalmente se le aplicó dipirona a dosis de 28 mg/kg, por vía endovenosa con el fin de controlar la temperatura. También se realizaron nebulizaciones con acetilcisteína 150 mg en 5 ml de solución salina, cada 6 horas por 1 semana.
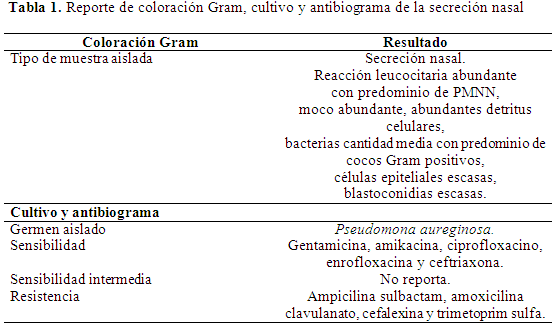
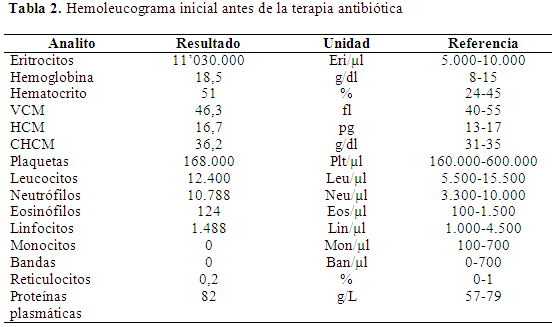
Examen laboratorio: Fue realizado un hisopado nasal externo de la secreción nasal, la cual fue transportada para cultivo en tubo con medio de transporte Stuart, refrigerado a 2°C, luego fue realizado tinción Gram, en la cual se determinó la presencia de un bacilo Gram negativo, posteriormente se cultivó en agar MacConkey, para bacterias Gram negativas, a las 48 horas se realizó lectura de la placa con la realización de pruebas bioquímicas, azúcar reductor, negativo para Pseudomona spp., fueron realizadas pruebas de úrea, zinc, citrato, lisina y TSI, para confirmar presencia del agente, No se encontró la presencia de otros agentes bacterianos Gram negativos como Mycoplasma, Chlamydophila, Bordetella o Pasteurella. Luego el antibiograma describió un halo de inhibición de mayor diámetro para ceftriaxona (Tabla 1). El hemograma completo demostró infección controlada, con valores de leucocitos 12.400/µl y neutrofilia de 10.788/µl, lo que indicaría la presencia de infección bacteriana, pero no pudo determinarse desviación a la izquierda o correlacionar con cronicidad del cuadro, además no se presentó bandemia. El resto de los valores del hemoleucograma, demostraron la hemoconcentración, la cual puede relacionarse con una posible deshidratación, con aumento en la línea roja (eritrocitos 11.030.000/µl, hemoglobina 18,5 g/dl, hematocrito 51%, volumen corpuscular medio (VCM) 46,3 fl, hemoglobina corpuscular media (HCM) 16,7 pg y concentración media de hemoglobina (CMHC) 36,2 g/dl; el resto de las pruebas demostraron normalidad (Tabla 2).
Fueron realizadas pruebas ELISA para FeLV y FIV (SNAP® Idexx Laboratories©, USA), las cuales fueron negativas para ambos virus.
Enfoque terapéutico: El paciente posterior a las pruebas realizadas, fue sometido a una terapia con amikacina a dosis de 10 mg/kg endovenoso, cada 12 horas por 6 días; se manejó la secreción nasal con acetilcisteína 70 mg/kg endovenoso cada 6 horas por una semana, también nebulizado con 150 mg de acetilcisteína en 5 ml de solución salina 0,9%, cada 4 horas, y se realizó una aplicación intranasal de oximetazolina 0,05%, 3 gotas cada 12 horas por una semana. El paciente permaneció canalizado con solución Pizarro, a razón de 50 ml/kg/día durante los 7 días de tratamiento.
Ayudas diagnósticas
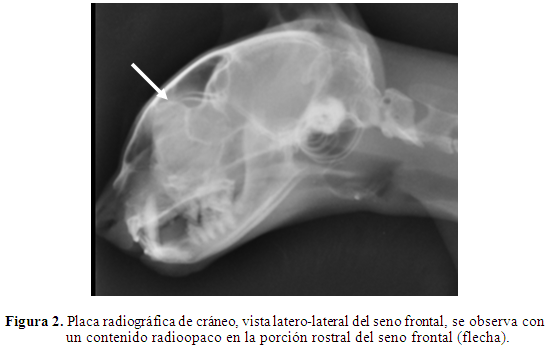
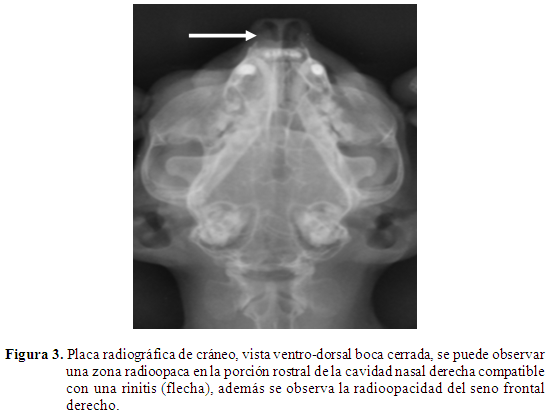
Radiología: Al paciente se le tomó placa de rayos X, latero-laterales y ventro-dorsales de cabeza y tórax, con el fin de descartar enfermedad respiratoria crónica, piotórax, traqueítis, colapso traqueal y lesiones espacio ocupantes en cavidad nasal; se pudo determinar áreas con cambios en la densidad en la porción rostral del seno frontal, de aspecto radioopaco, compatible con presencia de material purulento (Figura 2), en la vista ventro-dorsal con boca cerrada, se pudo observar radioopacidad en la cavidad nasal derecha y alteración en la densidad ósea, del seno frontal derecho (Figura 3); lo que es compatible con cuadro de sinusitis y rinitis crónica. No se pudo determinar la presencia de pólipos o masas espacio ocupantes, por lo cual se decidió realizar una rinoscopia.
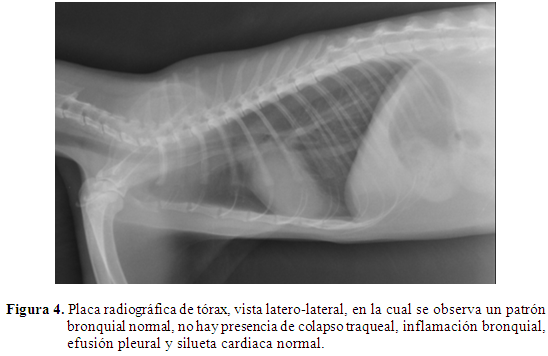
En la evaluación del tórax no se encontraron alteraciones inflamatorias, lesiones, masas o alteraciones en traqueo, bronquios y pulmón (Figura 4).
Rinoscopia: A las 24 horas, el paciente fue sometido a rinoscopia, bajo sedación con xilacina 0,3 mg/kg, tiletamina 2 mg/kg y zolacepam 0,5 mg/kg endovenoso. Solo se pudo determinar la obstrucción de la cavidad nasal del lado derecho, con un material mucopurulento denso de color verde oliva; se intentó hacer aspirado, pero no fue posible retirar todo el contenido.
Evolución: El paciente permaneció hospitalizado durante una semana, con el plan terapéutico comentado con anterioridad; el paciente no respondió a ninguna de las terapias medicamentosas, por consiguiente se decide realizar trepanación del seno frontal derecho, donde se presume que se encuentra el material purulento encapsulado.
Tratamiento quirúrgico: Una vez premedicado con xilacina 0,2 mg/kg, atropina 0,04 mg/kg, propofol 2 mg/kg vía venosa, se intubó el paciente, se anestesió con isofluorano 1 CAM y se realizó trepanación del seno frontal, incidiendo la piel de la región frontal derecha, adicionalmente se realizó lavado del seno frontal, con solución salina 0,9%; fue retirado el material purulento, permaneció con drenaje tubular y la piel fue suturada con polipropileno 3-0. Posteriormente realizaron lavados cada 12 horas con solución salina 0,9% durante una semana.
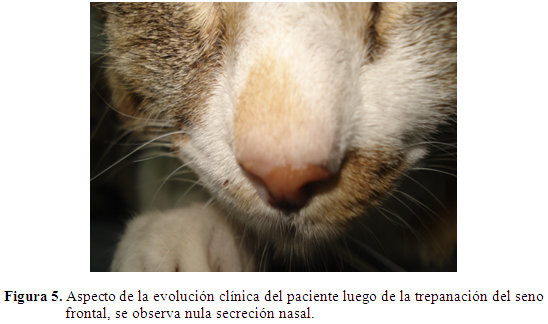
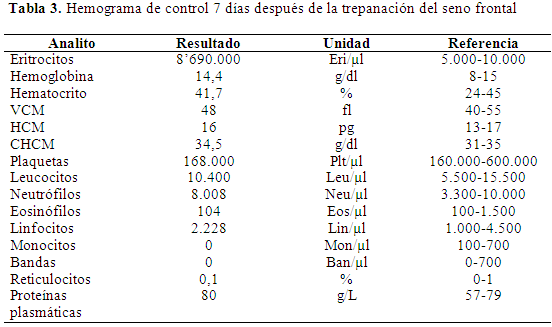
Respuesta al tratamiento quirúrgico y terapéutico: El paciente continúo con terapia antibiótica con ceftriaxona 25 mg/kg endovenoso cada 12 horas por una semana; el manejo analgésico se hizo con tramadol 3 mg/kg vía venosa cada 12 horas por 5 días y ketoprofeno 4 mg/kg, cada 24 horas endovenoso por 3 días. Después de una semana, el paciente mejoró los signos clínicos, no presentaba rinorrea (Figura 5), tuvo más apetito y se realizó un segundo hemograma, el cual mostró cambios, con respecto al inicial disminuyendo los valores de leucocitos y neutrófilos (Tabla 3). A la semana se dio de alta, clínicamente el paciente había resuelto el cuadro.
Discusión
Aunque la enfermedad respiratoria superior felina, es considerada una enfermedad de buen pronóstico y de características autolimitantes (Nelson & Couto, 2007; Cohn, 2011), algunos pacientes con rinosinusitis crónica felina, no mejoran, convirtiendo el cuadro en proceso frustrante, debido a las diferentes etiologías y al uso irracional de la terapia antibiótica (Scherk, 2010). La RCF, es la enfermedad más frecuente del sistema respiratorio felino (Azócar et al., 2008; Galler et al., 2012).
En el presente caso, se describe un felino hembra con un cuadro de rinosinusitis crónica de 6 meses de evolución con nula respuesta a la terapia reportada como efectiva para dicho cuadro (Ruch-Gallie et al., 2008). El paciente manifestó los signos clínicos característicos con rinorrea serosa a purulenta, estornudo y estertores (August, 2008; Bahr, 2008; Lara, 2012). Pero el paciente sometido a terapia descrita con amoxicilina, ampicilina y enrofloxacina no mejoró; esto debido a que se pudo aislar un germen menos frecuente como la P. aeruginosa que complicó el cuadro (Nelson & Couto, 2007; August, 2008; Bahr, 2008); esto probablemente es debido a los fenómenos de resistencia bacteriana descritos, donde se encontró una resistencia del 84% a la enrofloxacina (Escribano et al., 2009) y del 99% a los betalactámicos: ampicilina y amoxicilina (Cabrera-García, 2010); esto explica por qué dicho paciente felino, no mostró mejoría a la terapia referida.
El felino recibe la terapia de sostén recomendada por varios autores para el manejo de la enfermedad (Cohn, 2011; Greene, 2012), con antibióticos específicos reportados en el antibiograma (amikacina) y descritos como efectivos (Cabrera-García, 2010), pero el paciente no presenta recuperación, factiblemente debido a fenómenos de encapsulamiento del agente en el seno frontal. La baja respuesta a la terapia específica contradice lo descrito para la enfermedad, donde algunos autores indican que hay mejoría con una tratamiento específico (Stein & Lappin, 2001; Bahr, 2008; Lara, 2012); igualmente, el descarte de las causas contribuyentes como la presencia del virus de la leucemia felina (ViLeF) y de la inmunodeficiencia felina (VIF) (August, 2008), complican el cuadro descrito, pues eliminan las enfermedades inmunosupresoras como contribuyentes a la menor respuesta.
Las pruebas de laboratorio, en especial el hemoleucograma inicial, no demostraron el cuadro típico de rinosinusitis crónica felina, debido a que no confirman la presencia de un cuadro infeccioso típico, con leucocitosis y neutrofilia, lo cual es diferente a lo descrito por Johnson en 2003 (Johnson, 2003), pero el cultivo de la secreción nasal permitió llegar al diagnóstico poco frecuente de P. aeruginosa, comparado con las descripciones de otros autores, donde los microorganismos más frecuentes son: Chlamydophila felis con 90% (Ramsey, 2000; Nelson & Couto, 2007), Mycoplasma spp. (Johnson, 2003; Johnson et al., 2005) y Cryptococcus neoformans (Johnson, 2003), Staphylococcus spp. con 23% (Stein & Lappin, 2001) y Pasteurella multocida (Stein & Lappin, 2001; Johnson, 2003; Bahr, 2008).
El hallazgo de Pseudomona aureginosa, corrobora la tesis de Bahr en 2008, donde se indica que felinos con rinosinusitis crónica, presentan con más frecuencia este patógeno que los anteriormente mencionados; mientras que Ettinger & Feldman (2007), Nelson & Coutto (2007), indican que la Chlamydia es el microorganismo más importante. Otros autores como Cohn (2011), consideran que la presencia de Bordetella bronchiseptica como uno de los agentes más comunes en el complejo respiratorio felino, son el agente más prevalente, pero como oportunistas tras la infección por el virus de la rinotraqueitis infecciosa felina (VRF) y el calicivirus felino (CVF) (Cohn, 2011). Lo cual es apoyado por Lara en 2012 (Lara, 2012). La presencia de P. aeruginosa en el presente caso clínico, como agente causal convierte el cuadro como novedoso, pues es reportado como un germen poco frecuente y por primera vez reportado en la rinosinusitis crónica felina en Colombia.
La prevalencia de la P. aeruginosa en los exudados nasales de gatos con afección crónica, es una de las claves para comprender por qué los animales afectados no responden a la mayoría de los agentes antimicrobianos, dado los ya descritos mecanismos moleculares responsables del desarrollo de la resistencia fenotípica en Pseudomonas spp., estos ampliamente estudiados (Tejedor et al., 2003), y se basan en la mutación del gen gyr A, que controla el correcto enrollamiento de la doble hélice de ADN, y la sobre-expresión de sistemas proteicos denominados bombas de reflujo (efflux pumps) (Escribano et al., 2009).
Estos mecanismos pueden ser adquiridos por la bacteria (inducidos por una antibioterapia errónea o insuficiente), lo que puede ser atribuido al presente caso clínico, o bien ser intrínsecos, propios del microorganismo. En el caso de la resistencia adquirida, los microorganismos captan los genes que la codifican, a través de algún mecanismo de intercambio “sexual”. La resistencia intrínseca, por otra parte, puede deberse a mutaciones inducidas en el material genético propio del microorganismo, o a la sobre-expresión de estructuras bacterianas que pueden reutilizarse para impedir la entrada de antibióticos a la célula. En este sentido, es muy importante el papel que desempeñan los sistemas proteicos de reflujo (efflux pumps), que se encuentran en el espacio periplasmático de la pared celular, anclados entre la membrana externa y la membrana citoplasmática de la célula, y que son los encargados del reconocimiento del antibiótico y su expulsión (Escribano et al., 2009).
Con respecto a las imágenes radiográficas, el paciente fue sometido a dos vistas de las sugeridas para este tipo de alteración, la vista dorso-ventral y latero-lateral de cráneo, aunque algunos reportes recomiendan tres vistas más oblicuas de 20 grados lateral, rostro-caudal y rostro-caudal con boca abierta (Farrow et al., 1994). El paciente en las imágenes muestra signos radiográficos compatibles con rinosinusitis crónica, con áreas de opacidad aumentadas en tejido blando (Farrow et al., 1994; Thrall, 2002; August, 2008).
En cuanto a la rinoscopia, en el presente caso clínico los hallazgos fueron poco definitivos, comparados con las descripciones dadas por otros autores donde la descripción de las lesiones de la cavidad nasal son muy concluyentes (Ettinger & Feldman, 2007), para el autor la evaluación nasal solo permitió describir la presencia de abundante secreción nasal, pero no se pudo determinar el aspecto de la mucosa nasal.
La trepanación del seno frontal como estrategia para el manejo de la enfermedad, resultó ser el mejor tratamiento para el paciente, en el cual pudo ser retirado el material purulento, que se encontraba albergado en el seno frontal derecho; la técnica utilizada se basa en la descrita por Fossum (2009), y se logró mejoría similar a descripciones de otros autores (August, 2008).
El uso de la terapia antibiótica con ceftriaxona, con sensibilidad en el antibiograma y descrita en la literatura (Cabrera-García, 2010) y el drenaje por trepanación del seno nasal, permitieron la recuperación clínica del paciente. La rinosinusitis crónica felina como enfermedad de la vía respiratoria superior, es una enfermedad con un cuadro frustrante para el médico y el propietario por la baja respuesta a la terapia antibiótica (Scherk, 2010), esa es la razón por la cual se reporta este caso clínico y su terapia quirúrgica como estrategia eficaz para la eliminación del agente causal.
Conclusión
Debido a la complejidad del cuadro, a la falta de respuesta de la terapia con antibióticos y a que se trata de una enfermedad de comportamiento crónico, donde podrían estar involucrados otros agentes que pueden producir inmunosupresión, hace que el reporte de este caso clínico, sea de utilidad para otros clínicos en el manejo de la rinosinusitis crónica felina causada por un agente poco frecuente como la P. aeruginosa y abre una ventana a una nueva terapia fuera de la convencionalmente usada.
Referencias Bibliográficas
· August, J. Consultas en medicina interna felina. 1.ed. Buenos Aires: Intermédica, 2008. 796p. · Azócar, L.; Tamayo, R.; Thibautb, J. Estudio retrospectivo de las enfermedades respiratorias en felinos diagnosticadas clínicamente en el Hospital Veterinario de la Universidad Austral de Chile, Valdivia, durante el período 1997-2004. Arch Med Vet, v.40, n.3, p.289-294, 2008. · Bahr, A. Enfermedad respiratoria superior crónica: principios diagnósticos y terapéuticos. En: August, J. (Ed). Consultas en medicina interna felina. Buenos Aires: Intermédica, 2008. p. 357-368. · Cabrera-García, P.A. Utilización de antibióticos de uso humano en caninos y felinos atendidos en la clínica de pequeños animales de la Universidad Nacional de Colombia. Bogotá, Colombia: Universidad Nacional de Colombia, 2010. 72p. Tesis (Magíster en Ciencias - Farmacología). · Cohn, L.A. Feline Respiratory Disease Complex. Vet Clin North Am Small Anim Pract, v.41, n.6, p.1273-1289, 2011. · Escribano, C. et al. Sensibilidad de Pseudomonas spp. frente a las quinolonas en infecciones óticas y cutáneas en el perro y el gato. Clínica Veterinaria de Pequeños Animales, v.29, n.4, p.203-207, 2009. · Ettinger, S.; Feldman, E. Tratado de Medicina Interna Veterinaria. 6.eds. Madrid: Editorial Elsevier, 2007. 912p. · Farrow, C.S.; Green, R.; Shively M. Radiology of the cat. 1.ed. St Louis: Mosby, 1994. 480p. · Fossum, T.W. Cirugía en pequeños animales. 3.ed. Barcelona: Editorial Elsevier Health Sciences, 2009. 1632p. · Galler, A.; Shilbly, S.; Hirt, R. Chronic diseases of the nose and nasal sinuses in cats: a retrospective study. Schweiz Arch Tierheilkd, v.154, n.5, p.209-216, 2012. · Greene, C. Infectious diseases of the dog and cat. 4.ed. Missouri: Elsevier, 2012. 1020p. · Johnson, L. Update on feline rhinosinusitis. In: Proc 21st Ann AVIM Forum, 2003. p.262-265. · Johnson, L.R. et al. Assessment of infectious organisms associated with chronic rhinosinusitis in cats. Journal of the American Veterinary Medical Association, v.227, n.4, p.579-585, 2005. · Lara, V.M. Feline respiratory disease complex: main infectious agents. Ars Veterinaria, v.28, n.3, p.169-176, 2012. · Nelson, R.; Couto, G. Medicina Interna de Animales Pequeños. 6.eds. Buenos Aires: Interamericana, 2007.1992p. · Ramsey, D.T. Feline chlamydia and calicivirus infections. Vet Clin North Am Small Anim Pract, v.30, n.5, p.1015-1028, 2000. · Ruch-Gallie, R.A.; Veir, J.K.; Spindel, M.E. Efficacy of amoxycillin and azithromycin for the empirical treatment of shelter cats with suspected bacterial upper respiratory infections. J Feline Med Surg, v.10, n.6, p.542-550, 2008. · Scherk, M. Snots and snuffles: rational approach to chronic feline upper respiratory syndromes. J Feline Med Surg, v.12, n.7, p.548-557, 2010. · Stein, J.E.; Lappin, M.R. Bacterial culture results in cats with upper and lower airway disease. J Vet Inter Med, 15, p.320, 2001. · Tejedor, M.T.; Martín, J.L.; Navia, M.; Freixes, J.; Vila, J. Mechanisms of fluoroquinolone resistance in Pseudomonas aeruginosa isolates from canine infections. Vet Microbiol, v.94, n.4, p.295-301, 2003. · Thrall, D. Textbook of veterinary diagnostic radiology. 6.eds. USA: Saunders, 2012. 864p.
Molina, V.M. Rinosinusitis crónica felina por Pseudomona aeruginosa, reporte de caso. Veterinaria y Zootecnia, v.7, n.1, p.x-x, 2013.
<http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=134> |